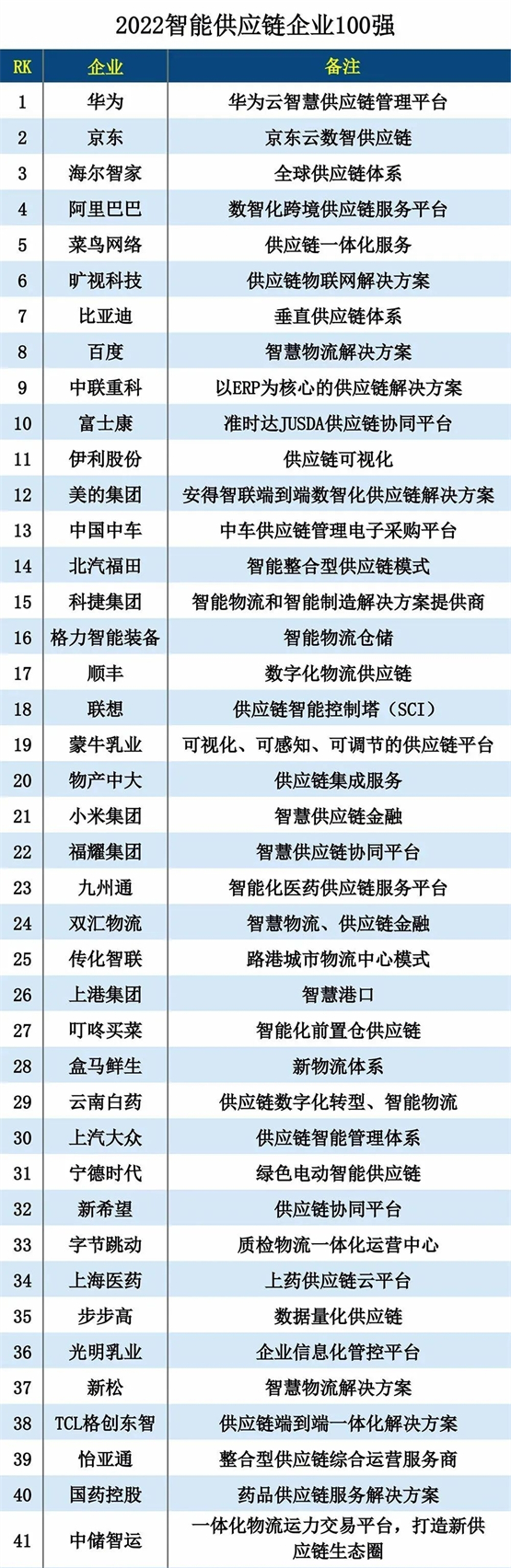
全球首个皮下注射PD-L1抗体恩沃利单抗注射液提交中国新药上市申请
先声药业集团有限公司(以下简称“先声药业”,股票代码:2096.HK)宣布:与康宁杰瑞生物制药(以下简称“康宁杰瑞”,股票代码:9966.HK)、思路迪医药(3D Medicines Inc.)达成战略合作的重组人源化PD-L1单域抗体恩沃利单抗注射液(研发代号:KN035)的新药上市申请(NDA),已正式提交给国家药品监督管理局(NMPA),申请的适应症为用于治疗既往标准治疗失败的微卫星不稳定(MSI-H)晚期结直肠癌、胃癌及其他错配修复功能缺陷(dMMR)晚期实体瘤。
恩沃利单抗注射液(KN035)是康宁杰瑞自主研发、思路迪医药负责其肿瘤适应症全球临床开发及商业化的重组人源化PD-L1单域抗体Fc融合蛋白注射液,先声药业负责中国大陆的商业化推广。恩沃利单抗注射液是全球首个用于肿瘤免疫治疗的单域抗体,获批上市后将有望成为全球第一款皮下注射PD-L1抑制剂。恩沃利单抗注射液与目前已经上市及在研的PD-1/PD-L1抗体相比具有明显的差异化优势:安全性良好、可皮下注射、常温下稳定,可轻松完成给药,大大缩短给药时间,更好地改善患者生活品质,为实现将肿瘤作为慢性病长期管理的目标迈出了关键的一步。
该项NDA申报是基于恩沃利单抗注射液单药治疗微卫星不稳定(MSI-H)/错配修复功能缺陷(dMMR)晚期实体瘤的Ⅱ期关键临床试验数据(NCT03667170)。本研究采用单臂开放标签设计,研究主要终点为独立审评委员会(BIRC)评价经确认的客观缓解率(ORR)。结直肠癌(CRC)和胃癌(GC)的MSI-H状态采用中心病理确认,其他肿瘤的dMMR状态采用当地病理评估结果。
研究共入组103名患者,总体人群(n = 103)BIRC评估的确认客观缓解率(ORR)为42.7%,CRC(n = 65)患者的ORR为43.1%;GC患者(n = 18)的ORR为44.4%;其他实体瘤患者(n = 20)的ORR为40.0%。总体人群BIRC评估的中位缓解时间(DOR)未达到,12个月DOR率为92.2%;中位无疾病进展期(PFS)为11.1个月;中位生存(OS)未达到,12个月OS率为74.6%。3/4级治疗相关不良事件发生率16%,无治疗相关不良事件导致死亡。3/4级免疫相关不良事件发生率为8%,未发生免疫相关肺炎、结肠炎、肾炎和神经系统毒性。9%的患者发生注射部位反应,均为1/2级。
先声药业董事长兼首席执行官任晋生先生表示:“我们很高兴与康宁杰瑞及思路迪医药三方合作推进恩沃利单抗取得重要的里程碑进展。鉴于恩沃利抗体在已开展临床试验中的良好结果与独特的给药方式,相信将为患者带来更多临床获益,同时极大地改善用药依从性。我们对该产品在中国的商业化前景及三方进一步推动其临床适应症的拓展、惠及更多患者充满信心。”
思路迪医药董事长兼首席执行官龚兆龙博士表示:“在2016年2月与康宁杰瑞签订合作协议后,思路迪医药快速推进恩沃利抗体的全球临床研究,从第一例病人在美国入组到现在,已经完成近1000例患者的临床试验,证明了恩沃利抗体的安全性和有效性。在与合作伙伴的共同努力下,我们终于迎来了申报上市的历史性时刻。以恩沃利单抗为起点,我们将进一步加大创新研发的力度,努力为中国乃至全世界的肿瘤患者提供疗效更优、可及性更高、使用更便捷的治疗选择,实现帮助肿瘤患者活得更久更好的愿景。”
康宁杰瑞创始人、董事长兼总裁徐霆博士表示:“KN035(恩沃利单抗注射液)是康宁杰瑞申报上市的第一个产品,有望成为全球第一款皮下注射PD-L1抗体,这是实现‘用我们的创新药物使肿瘤成为可控、可治的疾病,改善生活质量’目标的重要里程碑。根据国家药品注册相关的法律法规要求,后续我们将全力配合好国家药监部门和地方药监部门的审评流程。我们期待KN035能够早日获批上市,为这一患者群体及其家庭提供创新的治疗选择。”